各国開発の新型コロナウイルスワクチンが第3相試験を終え、次々と上市されていく雲行きだが、臨床試験不十分のワクチンが、ADE(抗体依存性感染増強)(antibody-dependent enhancement)現象を誘発する懸念が出てきた。
以下、メモ的に、順を追って詳述してみたい。
1.ADE(抗体依存性感染増強)現象とは何か?
(1)ADE(抗体依存性感染増強)とは?
ADE(抗体依存性感染増強)(antibody-dependent enhancement)とは
最初に獲得した不完全中和抗体を介し、その中和力はないがFc受容体への吸着力はあるという特性を利用(抗体依存性)して、
次に侵入した抗原(ウイルス)が、不完全中和抗体と複合体を組み、Fc受容体経路で細胞に入り込み、
細胞内で複製力を高める(感染増強)現象
をいう。
具体的には、
①新しい抗原(ウイルス)が、過去に出来ている「中和能力はないが吸着力のある不完全な中和抗体」と結びつき、
②新しい抗原と既成の不完全中和抗体との複合体が出来、
③単球またはマクロファージなどの免疫細胞を呼び寄せる不完全抗体の力を利用しながら、マクロファージの飲作用を利用して、Fc受容体を通過して細胞の中にはいりこみ、
④いったん細胞の中に入り込んだら、ウイルスの複製がうまくいくように、マクロファージのシグナル特性を、上方制御と下方制御の組み合わせで変えさせながら
ウイルス複製環境を増強していく
現象である。
このように、ADE(抗体依存性感染増強)現象は、本来は、宿主を保護するために作られたはずの抗体が、不完全な中和能力のものであったがために、再感染時において、今度は、宿主を助けるのではなく、ウイルスの複製を助ける側に回ってしまうという、きわめて、宿主にとってリスクの多い現象である。
ましてや、そのリスクの多い再感染が、本来は、宿主を救うはずのワクチン接種によっても、もたらされる危険性がある、ということである。
(2)抗体依存性感染増強(ADE)現象の歴史
A.ホークスの報告書がADE現象認識の始まり
ADE現象が認識された最初は、1964年のホークス(Hawkes RA. )による報告であった。
(参考 Hawkes RA. 「Enhancement of the infectivity of arboviruses by specific antisera produced in domestic fowls. 」Aust. J. Exp. Biol. Med. Sci.42, 465–482 (1964))
ホークスはこの報告書の中で、アルボウイルス(arbovirus)の感染力が、特定の抗血清の作用によって、見かけの感染力より増加していると指摘した。
アルボウイルスは、節足動物媒介性ウイルスともいわれ、蚊やダニなどの節足動物を介して,吸血 により脊椎動物に伝播されるウイルスである。
フラビウイ ルス科,トガウイルス科,ブニヤウイルス科,レオウイル ス科の多岐に属するウイルスである。
日本脳炎ウイルス(Japanese encephalitis virus)、西ナイルウイルス(West Nile virus)、ゲタウイルス( Getah virus)、マレーバレー脳炎ウイルス(Encephalitis Virus, Murray Valley)、などがあげられている。
B.いろいろなウイルス感染にもADE現象が
その後、1960年から1970年にかけて、同様の現象は、フラビウイ ルス科ウイルス感染を中心にして報告されてきた。
そのほか、
アルファコロナウイルス属では「猫伝染性腹膜炎ウイルス(FIPV)」
に、
ベータコロナウイルス属では「SARS-CoV-1」と「MERS」
に
同様のADE現象が見られている。
今回発生している新型コロナウイルスは、SARSコロナウイルスやMERSコロナウイルス と同じ「コロナウイルス科ベータコロナウイルス属」に分類されている。
参考「動物とヒトのコロナウイルスー2019新型コロナウイルスの流行を受けてー」
C.なぜ新型コロナウイルスにも、ADE現象が懸念されているのか?
また、新型コロナウイルスは「エンベロープを持つRNAウイルス」でもある。
「エンベロープを持つRNAウイルス」には、新型コロナウイルスが含まれるコロナウイルス科のほかに、フラビウイルス科などが含まれる。
参考「エンベローブ(ウイルス)」
フラビウイルス属は、73のウイルスがあり、そのうち、ヒトの重篤疾患に関与しているウイルスが約40ある。
フラビウイルス属は、共通の核酸ゲノム構造(正極性、約11kilobaseの一本鎖RNA)、組織(3つの構造たんぱく質、7つの非構造タンパク質)、粒子サイズ(約500オングストローム;Å)を有している。
この中で、ADE現象に関与しているフラビウイルス属ウイルスとしては、
先に記述した、1964年にホークスが報告している「アルボウイルス(arbovirus)」
や
西ナイルウイルス(West Nile virus)、
デング熱ウイルス(Dengue virus)、
ダニ媒介性脳炎ウイルス(Tick-borne encephalitis virus)、
黄熱病ウイルス(Yellow fever virus)、
ジカウイルス( Zika virus)
などがある。
そのほか
ヒト免疫不全ウイルス(HIV)(Human Immunodeficiency Virus)、
RSウイルス(RSV)(respiratory syncytial viru)、
エボラウイルス(Ebolavirus)、
インフルエンザウイルス(influenzavirus)、
口蹄疫ウイルス(FMD)(Foot-and-mouth disease virus)、
ネコ伝染性腹膜炎ウイルス(FIPV)(feline infectious peritonitis)、
ブタ繁殖・呼吸器障害症候群ウイルス(PRRSV)(Porcine reproductive and respiratory syndrome)
にも、ADE現象の発生がこれまで報告されている。
それ故に、新型コロナウイルスにも、ADE現象が懸念されているのである。
D.デング熱ウイルスからの教訓
なお、新型コロナウイルスの祖先ウイルスとみられているヒトコロナウイルスにはこれまで、下記のものが発見されている。
αコロナウイルス(γ祖先ウイルスに遠い)-HCoV-229E (1960年代に発見)、HCoV-NL63(2000年代に発見)、
βコロナウイルス(γ祖先ウイルスに近い)-SARS-CoV-2(2019年11月発見)、MERS-CoV(2012年9月発見)、SARS-CoV(2002年11月発見)、HCoV-OC43 (1960年代に発見)、HCoV-HKU1(2000年代に発見)

ADEはウイルスが抗体を利用し細胞侵入をはかり、Fc受容体との相互作用を介し細胞応答を変化させる現象であるが、このことについては、すでに2014年にスコット・B・ハルステッドがデング熱ウイルスや猫伝染性腹膜炎ウイルス(FIPV)などにつき下記論文を書いている。
「Pathogenic Exploitation of Fc Activity」
デング熱については、初回の感染時と異なる血清型のウイルスに再感染した場合に、ADE現象が発生することが報告されており、一方、ネココロナウイルスについては、初回の感染時と同じ血清型のウイルスに再感染した場合に、ADE現象が発生することが報告されている。
また、原因未解明のリーシュマニア症(leishmaniasis)(サシチョウバエの吸血により発症)にも、ADE現象が発生するといわれている。
(3)ADE(抗体依存性増強)の機序はどうなっているのか?
A.コロナウイルスが細胞内に入り込む二つの経路
コロナウイルスなど、エンベローブを持つウイルスの細胞侵入過程には次の二経路がある。
①ACE2受容体経路(エンドソーム/リソソーム経路)(endosomal pathway)
②Fc受容体経路(エンドサイトーシス経路)
このうち、ADE現象がみられるのは、②の「Fc受容体経路」である。
図1.ACE2受容体経路

図2.Fc受容体経路

上記2図は「COVID-19: Immunology and treatment options」(SusannaFelsensteinaJenny A.HerbertbPaul S.McNamarabChristian M.Hedrich)を参照
B. ADE誘発は IgG→FcγR(Fcガンマ受容体)経路で起きる
FcγR(Fcガンマ受容体)経由で細胞内侵入のウイルスへの免疫応答機序は下記のとおりである。
①過去に出来た不完全な抗体の存在
宿主内には、過去の感染や接種で産生された不完全な抗体(中和能力はないが、細胞への吸着能力がある抗体)が、既にある。
②新しい抗原と過去の不完全抗体との結合
新しく細胞内に進入しようとしている抗原(新しいウイルス粒子)は、この不完全抗体と結びつき、抗原と抗体との複合体を作る。
③免疫細胞のマクロファージのFc受容体が抗原抗体複合体を認識&結合
免疫細胞であるマクロファージの表面には、Fc受容体があり、不完全中和抗体(免疫グロブリンIgG)の複合体のFc領域を捕らえる分子が出ている。
抗原・抗体の複合体から、抗体の一部を受容体が認識し、結合する。
こうして、過去の不完全な中和抗体が橋渡しをする形で、抗原(新しいウイルス)&過去に産生の不完全中和抗体(免疫グロブリンIgG)の複合体が、マクロファージの表面上のFcγ受容体(Fcガンマ受容体)に吸着&結合する。
抗原(ウイルス)は、過去に出来た不完全抗体と結合したまま、マクロファージの中に取り込まれ、このことで、マクロファージ自体がウイルスに感染してしまう。
低親和性(結合力が弱い)のFcγ受容体(Fcガンマ受容体)は、オプソニン化(抗原に抗体や補体が結合することにより抗原が食細胞に取り込まれやすくなる現象)が促進され、活性化する。
Nikolai Eroshenko等によれば、最初の感染によって誘発された抗体を、新たに侵入の抗体をIgG抗体&Fcガンマ受容体へ、免疫細胞へのウイルスの侵入を可能にするためブリッジするので、ウイルスの向性が変化するためとしている。
既存の抗体には、感染中和の力はないが、Fcガンマ受容体を介しての抗原(ウイルス)の取り込みを誘発する力がある。
そして、既存の抗体は、マクロファージなどの免疫細胞のターゲットとしての機能を果たす。
ウイルスは、宿主の持つ過去に出来た不完全な抗体を「トロイの木馬」として、免疫細胞のターゲットとして差し出し、免疫細胞の食作用のプロセスをだまして利用し、細胞内に入り込む。
④マクロファージがエンドサイトーシス(貧食作用)により複合体を飲み込む
マクロファージはエンドサイトーシス(貧食作用)によって、これら複合体を細胞内に飲み込む。
新しいウイルスは細胞内に入り込み、細胞内のウイルス・ビリオンを増やす(外生的ADE)(B細胞・液性免疫の段階での増強)
⑤本来のマクロファージの機能は?
本来は、マクロファージは次の三つの機能を持つ。
食作用(抗原-ウイルス-を摂取)
↓
抗原提示(食作用によって取り入れた異物を分解して細胞表面に表出させる。これが抗原提示。これがシグナルとなって、ヘルパーT細胞を活性化。)
↓
活性化(マクロファージはT細胞の生産するサイトカインを受け取ることにより活性化)
⑥そして、補体がマクロファージを補助しウイルスを加水分解するはずだが?
この免疫細胞(マクロファージ)の貧食作用を補助するものとして補体があり、マクロファージが食作用で取り込んだウイルスを、補体が、加水分解していく。
本来は、抗原と複合体を形成したIgGにタンパク質複合体C1qが結合し、それをトリガーに「C1→C4→C2→C3b」の経路(古典的経路)でタンパク質分解酵素の生成で、エンべロープウイルスの周りを囲んでいる脂質層の蛋白質を加水分解していく。
なお、第三成分 (C3)が分解されるまでの補体系の活性化には、次の三つのプロセスがある。
古典経路=抗体が関与。補体第一成分 (C1) がC1qを介して結合。
副経路(第二経路)=抗体は関与しない。幾つかの成分の関与でC3が活性化。
マンノース結合レクチン(MBL)経路=MBL(またはMBP (マンナン結合蛋白))が病原体表面の糖鎖に結合して活性化。
⑦補体のエフェクター機能発動までの機序
ADE現象においては、具体的には、以下の図で
a.b.抗原・抗体の複合体にC1qが結合→c.補体のC3.C3a.C5aが活性化、膜侵襲複合体(MAC)が活性化→d.e. IgG Fc受容体は、骨髄細胞上のFcγRに結合し、エフェクター機能を発動させる。→
C3とC5aは骨髄細胞による食作用を促進→d.マクロファージ&樹状細胞による抗体依存性食作用が起きる。→e.ナチュラルキラー(NK)細胞により抗体依存性細胞傷害が媒介。→f.食細胞によるウイルス&ウイルス感染細胞の取り込み後、抗原提示、抗ウイルスT細胞活性化

参考「A perspective on potential antibody-dependent enhancement of SARS-CoV-2」
⑧マクロファージがウイルスに感染し、本来発すべきシグナルを変質させる
ところが、ウイルスに感染したマクロファージは、本来のシグナルを変質させていく。
本来は、複合体を認識したマクロファージは、抗原提示のシグナルを出し、飲み込まれたウイルスは、補体の力を借りて、免疫細胞内で破壊&排除されるはずであるが、細胞内に入ったウイルスがマクロファージに感染(免疫細胞の感染)し、そのマクロファージの出すシグナルを変質させ、自然免疫を抑制させていく。
このマクロファージのシグナルの可逆的な変質を「マクロファージの極性化(Polarization)」という。
マクロファージのシグナル機能が可逆的な極性化によって再プログラム化され、それまでの炎症性細胞から、調節性細胞へ移行していく。
(内生的ADE)(T細胞・細胞性免疫の段階での増強)
⑨マクロファージのシグナル機能の極性化による自然免疫の抑制
マクロファージのシグナル機能の極性化によって、自然免疫は抑制され、結果、ウイルス産生増加は促進される。
インターロイキン10(IL-10)産生増加
ヘルパーT細胞のTh2細胞応答を偏らせる
⑩マクロファージの抗原提示シグナルの変質
マクロファージの出す抗原提示のシグナルにより
T細胞の中のヘルパーT細胞(リンパ球)に伝達。
T細胞活性化で、インターロイキンなどのサイトカインを生産・放出するが、マクロファージのシグナルの変質で、通常とは異なったものとなる。
すなわち
抗原提示のシグナルを送り、
T細胞のなかのヘルパーT細胞(リンパ球)に伝達、
T細胞活性化で、インターロイキンやリンフォカイン等のサイトカインを生産・放出させる。
⑪その結果は?-シグナルの変質化による免疫応答の遅延化で、ウイルス複製環境は増強へ-
シグナルのアップレギュレーションとダウンレギュレーションの相互作用で、免疫応答が遅延してくる。
ここで、もう一度、図2の「Fc受容体経路」に基づいてみてみよう。

マクロファージで取り込まれた抗原&抗体の複合体は、マクロファージの伝達シグナル特性を変えさせ、
①マクロファージのⅠ型IFNシグナル伝達(図のcとe)を阻害(ダウンレギュレーション)
②炎症性サイトカインIL-1.IL-6を発現可能(アップレギュレーション)
③TNFαの発現(図のf)増強(アップレギュレーション)
となり、
結果
Th1サイトカインIL2、TNF-α、IFN-γ減少
Th2サイトカインIL-10、IL-6、PGE-2、INF-α増加
となり、STAT転写因子経路を阻害し、
総合としては、ウイルス・ビリオンの複製環境体制を増強
④マクロファージがエンドサイトーシス(貧食作用)により複合体を飲み込む
マクロファージはエンドサイトーシス(貧食作用)によって、これら複合体を細胞内に飲み込む。
新しいウイルスは細胞内に入り込み、細胞内のウイルス・ビリオンを増やす(外生的ADE)(B細胞・液性免疫の段階での増強)
参考
抗体依存性増強のメカニズム
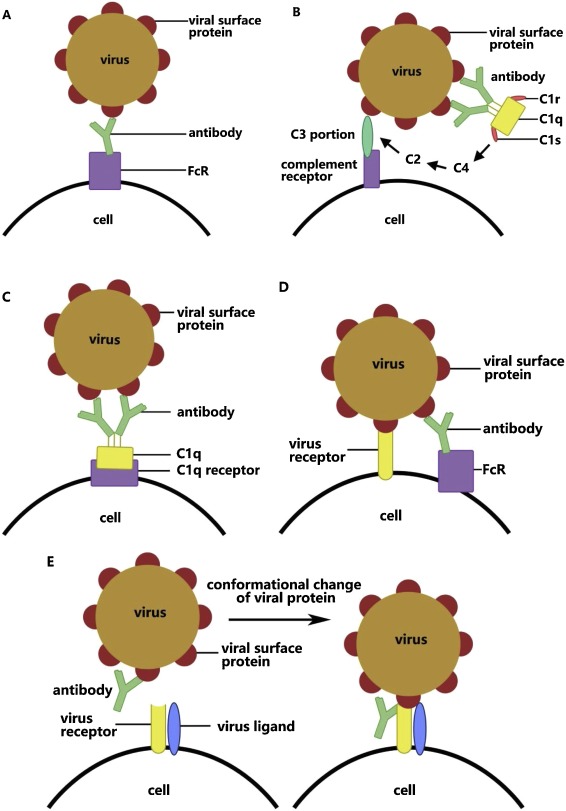
上記図でのABCD各段階での流れにもとずいて説明。
A.
ウイルス表面蛋白質が抗体と結合し、ウイルス・抗体複合体を形成A
この複合体が抗体のFc部分と、特定の細胞表面のFcR受容体と相互作用し、ウイルスの接着を強化。
B.
ウイルス表面蛋白質の抗体の結合により、補体C3が古典的経路で活性化。
補体Cと対応する受容体との間の相互作用により、「ウイルス-抗体-補体」複合体により、ウイルスの接着を強化。
補体C1の一部のC1q分子がセリンプロテアーゼプロ酵素であるC1rおよびC1sと共に機能。
次に、C1qが抗体複合体に結合すると、C1rおよびC1sは、血漿中のC1阻害剤の作用によりC1qから離れる。
C1が補体C2とC4を切断、C1qが離れたエフェクター補体C3と細胞上の受容体との間の組み合わせを活性化。
ウイルスは補体受容体に結合。
C.
ウイルス-抗体複合体はC1qにより結合。
C1qと受容体と結合・沈着化によりウイルスカプセルと細胞膜との融合を活性化。
D.
ウイルスの特性変化により、上方制御と下方制御の組み合わせにより、抗ウイルス遺伝子の発現が抑制。
腫瘍壊死因子(TNF)や誘導一酸化窒素シンターゼなどの抗ウイルス遺伝子の抑制により、免疫応答回避。
E.
ウイルスが抗体と結合することにより、ウイルス蛋白質のコンフォメーション(タンパク質高次構造)が変化。
ウイルスと細胞との融合が強化。
参考「Antibody-dependent enhancement of coronavirus」
C.抗原と不完全中和抗体との複合体が出来るまで
a.Fc受容体とは?
抗体のFc領域が担う機能をエフェクター機能という。
Fc領域はそれぞれに特異的なFc受容体に結合し,Fc受容体をもつ細胞を活性化したり,抗体の細胞間トランスポートに働く.
Fc受容体は、
マクロファージや単球などの食細胞、
好中球や好酸球などの顆粒球、
自然免疫系(ナチュラルキラー細胞)や適応免疫系(B細胞など)のリンパ球
など、
免疫系の多くの細胞に見られる。
Fc受容体は、抗体に結合することを可能にする。
抗体に結合し、食細胞の活性化によって、細胞が抗原を排除するのを助ける。
Fc受容体は、Bリンパ球、マクロファージ、ナチュラルキラー細胞、好中球、マスト細胞などの細胞の表面上に存在する。
b. Fc受容体に対応する抗体
Fc受容体に対応する抗体の構造は
Y字型をしており、
F(ab)「アーム」という2本の部位は、抗原への結合領域
Fc「テイル」という1本の部位は
①Fc受容体への結合領域
と
②Fc領域
からなる。


c.5つの免疫グロブリン分子に対する、それぞれ5つのFc受容体
Fc「テイル」の受容体となるFc受容体には次の5つのサブクラスがあり、
5つの免疫グロブリン分子に対しそれぞれ5つのFc受容体
が対応している。
免疫グロブリン分子→Fc受容体
①IgG→FcγR(Fcガンマ受容体)
(IgGは血中で最も豊富に認められる抗体。産生されるサイトカインの種類によって、4種類のIgGのサブクラスがある。
IgG1およびIgG3は、食細胞のFc受容体に高い親和性を示す。
食細胞のFc受容体経由オプソニン化(抗原に抗体や補体が結合することにより抗原が食細胞に取り込まれやすくなる現象)に有効。
Fc領域を介してナチュラルキラー細胞にも結合することができる。
抗体依存性の細胞毒性に寄与)
②IgE→FcεR(Fcイプシロン受容体)
(IgEは粘膜表面、血液、組織において機能)
③IgD→FcδR(Fcデルタ受容体)
(IgDはほとんどのBリンパ球の表面に存在)
④IgM→FcμR(Fcミュー受容体)
(IgMは新生児が最初に合成する免疫グロブリン)
⑤IgA→FcαR(Fcアルファ受容体)
(IgAは中和抗体としての作用)
参考「抗体の仕組みと種類を理解しよう」

d.ADE誘発に関わるFcγR(Fcガンマ受容体)に対する免疫グロブリン分子はIgG
ADE誘発に関係のFc受容体はFcγR(Fcガンマ受容体)で免疫グロブリン分子IgGの受容体である。
なお、新生児の抗体であるIgMも、ADEを誘発しうるとの説がある。

結合リガンド(特異結合物質)
は、上から
→抗原(Antigen)と結合
→糖鎖修飾誘導体(Glycan receptor)と結合
→Fc受容体(FcR)と結合
参考「Pharmacokinetics of monoclonal antibodies and Fc-fusion proteins」
免疫応答を引き出す新しいウイルス抗原は既存の抗体の免疫グロブリン分子IgGと結合し、抗原と抗体の複合体完成でIgGのY字の根元部分で受容体に結合する。
ADE現象を誘発する抗体は
F(ab)の結合力が弱いが、Fcの結合力が強いので、免疫細胞を捕らえてしまう。
これには、Fc部位の糖化状態が、関係しているとの説もある。
IgG応答は、ウイルス検出後、7日後から観察され、長期間にわたり、高いレベルで続くことがある。
なお、上記「糖鎖修飾誘導体(Glycan receptor)と結合」がADE現象に与える影響については、研究文献が少ないが、例えば、代表的な翻訳語修飾としてある「リン酸化」や「フコース」がウイルス核内移行やサイトカイン産生などにどう影響しているのか?については、興味のあるところである。
D. ACE2受容体経路は、ADEには無関係なのか?
ACE10経路の受容体は、スパイクタンパク質主体の受容体ではあるが、単球・マクロファージの受容体としては、発現が低い。
しかし、スパイクタンパク質の表面のエピトープ(抗体が認識する抗原の一部分)の異なる部分の認識によって不完全中和抗体が出来ている可能性は十分ある。
ましてや、現在世界で開発の新型コロナウイルスワクチンは、ほとんどが、ウイルスのスパイクタンパク質を標的にしたものである。
十分な力価を持ち、十分な中和抗体を形成するワクチンなら、ACE2受容体へのS蛋白質結合をブロックしうる。
本来は、スパイク蛋白質とその免疫は防御免疫応答を誘発しうるはずである。
しかし、中途半端な力価のワクチンが交差反応を起こして、不十分な中和抗体を形成し、これが、新規のウイルスの抗原&抗体複合体形成のための標的になり、FcγR(Fcガンマ受容体)経由で細胞に侵入してくる機会は十分想定しうる。
これらの複合体は、抗体力はないが、受容体への吸着力はある。
抗スパイクIgGの存在が、マクロファージ/単球におけるFcγRIIシグナル伝達を介して、免疫応答を歪めることで、ADE感染増強に関連している可能性は考えられる。
E.過炎症の指標
ADE現象の結果として起こりうるサイトカインストームによる過炎症(またはさらに超炎症;Hyper inflammation)の指標として、次のものがあげられている。
白血球(WBC)数
好中球
リンパ球数
好中球/リンパ球比(NLR)
血小板/リンパ球比(PLR)
このうち、好中球/リンパ球比(NLR)は、全身性炎症のマーカーとして、注目されている。
この比率が3を超えると、リンパ球の相対的減少状態にあるとされ、細胞性免疫の低下とみなされる・
新型コロナウイルス感染による重症化の指標とされている。
2.「抗体依存性感染増強」(ADE)現象を防ぐには?
(1)ADE誘発の最大の原因は、過去から存在していた不十分な中和抗体の存在
これまで見たように、ADE誘発の最大の原因は、次のような不完全中和抗体の存在である。
①過去の中途半端なウイルス感染や質の悪いワクチン接種によって出来た力価の不十分な中和抗体
②異種ウイルスに対する交差反応によって出来た不十分な中和抗体
③スパイクタンパク質の表面のエピトープの異なる部分の認識によって、過去に出来た不完全中和抗体
④他のコロナウイルス(先祖ウイルスかもしれないコウモリコロナウイルス)のプライミング(初回感染曝露時に免疫系を賦活するための予備刺激or準備刺激or初回刺激)によって発生した不完全中和抗体
⑤T細胞のTh2応答を刺激したかもしれない、過去に接種の麻疹ワクチンによって産生されたワクチン抗体
⑥血清型が異なるために、単に亜中和されただけの不完全中和抗体
⑦風土病化した不顕性感染のウイルスに曝露されてきた宿主が持っている不完全中和抗体
の存在である。
これらの存在が、ウイルスへの再感染やワクチンの再接種によって、ADE現象を生み出す要因になっている。。
これらは、中和抗体を作る能力はないが、Fc受容体に結合する能力がある。
そのために、ADE現象を引き起こしてしまっている。
(2).モノクローナル抗体とADEの関係は?
現在、新型コロナウイルスに対するモノクローナル抗体(mAb)としては、次の8つが研究されており、それぞれ臨床試験の段階にある。
①REGN10933+REGN10987(アメリカ)
Regeneron/N IAD
②LY3819253(LY-CoV555)(カナダ/アメリカ)
AbCellera/Eli Lilly
③JS016(中国/アメリカ)
Junshi Biosciences (上海君实生物医药科技股份有限公司)/Institute of Microbioligy.Chinese Academy of Sciences/Elilily
④TY027(シンガポール)
Tychan
⑤CT-P59(シンガポール)
Celltrion
⑥BRII-196(中国/アメリカ)
Brii Bio/TSB Therapeutics/Tsinghua University(清華大学)/The 3rd People’s Hospital of Shenzhen(深圳市第三人民医院)
⑦BRII-198(中国/アメリカ)
Brii Bio/TSB Therapeutics/Tsinghua University(清華大学)/The 3rd People’s Hospital of Shenzhen(深圳市第三人民医院)
⑧SCTA01(中国)
Sinocelltech Ltd(神州细胞)/Chinese Academy of Sciences(中国科学院)
参考
「Clinical studies evaluating anti-SARS-CoV-2 monoclonal antibodies」
これらのmAbの投与が、ADEの原因につながる不完全抗体を生みうるかどうか?については、今後の研究が必要のようである。
ちなみに、デング熱については、哺乳類細胞で産生されたmAb(mammalian-cell-produced)は、ADE誘発の懸念があるが、植物細胞で産生されたmAb(plant-based)は、ADE誘発の危険性は少ない、との研究結果はすでにある。
(3)ADE誘発は細胞性免疫の誘導失敗が原因
では、どうやってADE誘発リスクをコントロールするのか?
免疫は、そのメカニズムによって2つに大別される。
1つは、液性免疫と呼ばれ、ワクチンの接種や過去の感染によって体内で作られる抗体が活躍する。
抗体には、病原体などに結合することで感染力や毒性を失わせる作用を持つものや、マクロファージなどの免疫細胞による取り込み・処理を助けるものなどがある。
2つは、細胞性免疫と呼ばれ、マクロファージやキラーT細胞といった免疫細胞が病原体や病原体に感染した細胞を直接取り込み(貪食と呼ばれる)、処理することで体を守るシステムである。
細胞性免疫はマクロファージ、キラーT細胞等免疫細胞が感染細胞を貪食で守る。
ADE誘発は、新しいウイルスが、液性免疫の機序を利用して、過去に出来ていた「中和能力はないが吸着能力のある抗体」と複合体を形成し、細胞の中に入り込んだ。
過去の液性免疫の存在が、ADE現象を生み出すもともとの原因であるともいえる。
その次に、免疫細胞であるマクロファージの可逆的極性化特性を利用して、マクロファージのシグナル特性を、ダウンレギュレートの方向に替え、ウイルスの複製環境を整えた。
この後者のマクロファージの特性を変えさせたのは、細胞性免疫の誘導に失敗したためであり、そこにADE現象は起こっている。
ヘルパーT細胞のうち
細胞性免疫の調節がTh1
抗体産生など液性免疫の調節がTh2
で行われるが、ADE現象は、Th1のアップレギュレーションによって、腫瘍壊死因子であるTNF-αの増強を許してしまっていることによる。
ADE現象の発生を回避するには、
細胞免疫の調整を司るTh1と
液性免疫の調整を司るTH2と
のバランスが重要になってくる。
これらの宿主にとっての好ましくない免疫応答が「外生(液性免疫)と内生(細胞性免疫)との二段階」で増強される現象が生じてくる。
図 内生(細胞性免疫)ADE

機序
①抗原と抗体との複合体は、免疫細胞上のFc領域へ結合後、細胞内に内在化
②Th1サイトカインのIL2、TNF-α、IFN-γ を減少させる。
Th2サイトカインのIL-10、IL-6、PGE-2、INF-α を増加させる。
結果、STAT経路を阻害し、免疫応答レベルを低下させる。
③抗ウイルス応答の抑制により、結果として、ウイルス複製は増加。
図 外生(液性免疫)ADE

機序
①抗原&抗体の複合体形成
②複合体が免疫複合体と結合し、補体経路を活性化
③補体フラグメントC4bとC2aとが動員され、C3転換酵素を生成、次にC3が加水分解され、C3bが生成
④C3bは、ウイルスに結合し、CR保有細胞の受容体(CR)を補う
⑤細胞の溶解をし、疾患の悪化を促進させる。
上記図は「Viral-Induced Enhanced Disease Illness」より引用
3.ADEを誘発させない新型コロナウイルスワクチンの条件とは?-終わりに-
ここで、ワクチン接種によって十分な中和抗体が出来るか?が問題となる。
ADE応答は抗体価に依存する。
抗体が低濃度で存在の場合はADEが発生するが、高濃度で存在の場合にADEが発生しない。
また、中和抗体の親和性(結合力)が低い場合にも、ADE現象は発生する。
理 想 的 なワクチンは、SARS-CoV-2 に対して特異的かつ効率的に作用する中和抗体を産生するものでなければならない。
しかし、一定のワクチンの中には、中和抗体の力価が不十分であるために、抗体依存性増強(ADE)が引き起こされる可能性があるワクチンもありうる。
また、ADEと似た症状に「ワクチン過敏反応」(VAH)があるが、これとADE現象と混同しない対応が求められる。
ワクチン抗体産生が不十分で産生された抗体は、新しい感染ウイルスとが結合し、免疫複合体を生成し、Fc受容体経由で、細胞の中に進入する。
十分な力価のないワクチンで産生された抗体、または再感染ウイルスと免疫複合体を作り、ACE2受容体経由でなく、FcγR(Fcガンマ受容体)経由で、マクロファージによる貪食作用で細胞内に進入する。
これらのことから言えば、理想的な新型コロナウイルスワクチンは、「抗体が関与する液性免疫を誘導することなく、細胞性免疫を優位に誘導するワクチン」ということになる。
ワクチン設計にあたり、中和抗体と強力なT細胞性免疫の両方を誘導でき、かつ、ADE誘導性、非中和性、または弱中和性のエピトープを除外することが必要になりうる。
また、中和抗体の出来にくい低力価のワクチンはADE誘発を招きかねず、そのためには、最初のワクチン接種で高力価を保証するための、アジュバントの開発も必要となりうる。
ある識者は、
「S蛋白質に対する不完全な免疫(抗体)が誘導されれば、ADEが起こる可能性がある。
細胞性免疫を誘導するワクチンの開発は、(ADEを防ぐための)1つの手段になり得る。
ウイルスのS蛋白質のうち、感染において特に重要な役割を担う一部の領域をターゲットにしたワクチンを開発することで、不要なエピトープの認識することなく、そのことで、不要な不完全S抗体を生むこともなくなる」
と指摘している。
新型コロナウイルスの不完全抗体にもADE現象誘発の懸念があるかどうかは、まだ、わかっていないが、つい最近、中国の復旦大学のHuang氏らが、次のような報告をしている。
特定の新型コロナウイルス患者に「7F3」と呼ばれる高リスク抗体(ADE現象を誘発)を発見したとして、222人の患者のうち、軽度症状者の8%、回復者の76%に「7F3」抗体が見つかったとして、この高リスク抗体がADE現象を誘発するのではないか?との仮説を示している。
参考
以上
参考
1.現在開発中の新型コロナウイルスワクチン一覧

2.現在開発中のモノクローナル抗体一覧

参考文献
「Antibody-Dependent Enhancement (ADE) Phenomenon Could Be Caused By SARS-COV-2 Antibody」(2020/09/29)
「Immunoglobulin G2 Antibody as a Potential Target for COVID-19 Vaccine」(2020/09/29)
「Immune Response to COVID-19: Can We Benefit from the SARS-CoV and MERS-CoV Pandemic Experience?」 (2020/09/18)
「Another study by researchers from Nanjing University Medical School 」 (2020/09/11)
「Antibody-dependent enhancement of coronavirus」(2020/09/10)
「Antibody-dependent enhancement and SARS-CoV-2 vaccines and therapies」 (2020/09/09)
「Antibody-dependent enhancement of Coronavirus」(2020/09/07 )
「Immunological considerations for COVID-19 vaccine strategies」 (2020/09/04)
「Four scenarios on how we might develop immunity to Covid-19」 (2020/08/26)
「Structural and dynamical analysis of integrated human/SARS-CoV-2 metabolic models present novel treatment strategies against COVID-19」 (2020/08/14)
「Deciphering SARS-CoV-2 Virologic and Immunologic Features」 (2020/08/14)
「COVID 19 Vaccines: Should we fear ADE? 」 (2020/08/12)
「The role of IgG Fc receptors in antibody-dependent enhancement」(2020/08/11)
「Presence of Genetic Variants Among Young Men With Severe COVID-19」 (2020/07/24)
「Immunity 101 for COVID-19」 (2020/07/18)
「A perspective on potential antibody-dependent enhancement of SARS-CoV-2」 (2020/07/13)
「COVID-19 Coronavirus Vaccine Design Using Reverse Vaccinology and Machine Learning」 (2020/07)
「Implications of antibody-dependent enhancement of infection for SARS-CoV-2 countermeasures」 (2020/06/05)
「Impact of immune enhancement on Covid-19 polyclonal hyperimmune globulin therapy and vaccine development」 (2020/05/01)
「What immunity to Covid-19 might actually mean」(2020/04/23)
「The potential danger of suboptimal antibody responses in COVID-19」(2020/04/21)
「Coronavirus could attack immune system like HIV by targeting protective cells, warn scientists」(2020/04/18)
「SARS-CoV-2 and COVID-19 in older adults: what we may expect regarding pathogenesis, immune responses, and outcomes」 (2020/04/10)
「RETRACTED ARTICLE: SARS-CoV-2 infects T lymphocytes through its spike protein-mediated membrane fusion」 (2020/04/07)
「COVID-19: Immunology and treatment options」 (2020/04)
「Hypothesis for potential pathogenesis of SARS-CoV-2 infection–a review of immune changes in patients with viral pneumonia」 (2020/03/18)
「Immune responses in COVID-19 and potential vaccines: Lessons learned from SARS and MERS epidemic 」 (2020/03)
「Coronavirus infections and immune responses」 (2020/01/25)
「Viral-Induced Enhanced Disease Illness」(2018/12/05)
「Molecular Mechanism for Antibody-Dependent Enhancement of Coronavirus Entry」(2019/12/04)
「FcγRs Muscle Up Dendritic Cell Cross-Presentation」 (2013/01/09)
「Viral Innate Immune Evasion and the Pathogenesis of Emerging RNA Virus Infections」 (2019/10/18)
「Molecular Mechanism for Antibody-Dependent Enhancement of Coronavirus Entry」 (2015)
「Antibody Dependent Enhancement」 (2014)
「Antibody identification」 (?)
「SARS-CoV-2 (COVID-19) S1 protein (D614G), His Tag」 (?)
「Immunology Research Scope」 (?)
「免疫グロブリンFc受 容体を介 した免疫抑制機構」(2000)
「フローサイトメトリー (FCM) / FACS 抗体は、Fc受容体ブロッキングによって検証されます」(?)
以上